ໃນປັດຈຸບັນ, ພະຍາດຕັບໄຂມັນທີ່ບໍ່ແມ່ນເຫຼົ້າ (NAFLD) ໄດ້ກາຍເປັນສາເຫດຕົ້ນຕໍຂອງພະຍາດຕັບຊໍາເຮື້ອໃນປະເທດຈີນແລະແມ້ແຕ່ຢູ່ໃນໂລກ. ລະດັບຂອງພະຍາດປະກອບມີ steatohepatitis ຕັບງ່າຍດາຍ, steatohepatitis ທີ່ບໍ່ມີເຫຼົ້າ (NASH) ແລະພະຍາດຕັບແຂງແລະມະເຮັງຕັບ. NASH ມີລັກສະນະການສະສົມໄຂມັນເກີນໃນ hepatocytes ແລະເຮັດໃຫ້ເກີດຄວາມເສຍຫາຍຂອງຈຸລັງແລະການອັກເສບ, ມີຫຼືບໍ່ມີ fibrosis ຕັບ. ຄວາມຮຸນແຮງຂອງໂຣກ fibrosis ຕັບໃນຄົນເຈັບ NASH ແມ່ນກ່ຽວຂ້ອງຢ່າງໃກ້ຊິດກັບການຄາດຄະເນຂອງຕັບທີ່ບໍ່ດີ (ໂຣກຕັບແຂງແລະອາການແຊກຊ້ອນຂອງມັນແລະໂຣກມະເຮັງຕັບ), ເຫດການຂອງເສັ້ນເລືອດຫົວໃຈ, ໂຣກມະເລັງ extrahepatic, ແລະການເສຍຊີວິດທັງຫມົດ. NASH ສາມາດສົ່ງຜົນກະທົບຕໍ່ຄຸນນະພາບຊີວິດຂອງຄົນເຈັບ; ຢ່າງໃດກໍຕາມ, ບໍ່ມີຢາຫຼືການປິ່ນປົວທີ່ໄດ້ຮັບການອະນຸມັດເພື່ອປິ່ນປົວ NASH.
ການສຶກສາທີ່ຜ່ານມາ (ENLIIVEN) ຈັດພີມມາຢູ່ໃນ New England Journal of Medicine (NEJM) ສະແດງໃຫ້ເຫັນວ່າ pegozafermin ປັບປຸງທັງສອງ fibrosis ຕັບແລະການອັກເສບຂອງຕັບໃນຄົນເຈັບ biopsy-confirmed non-cirrhotic NASH.
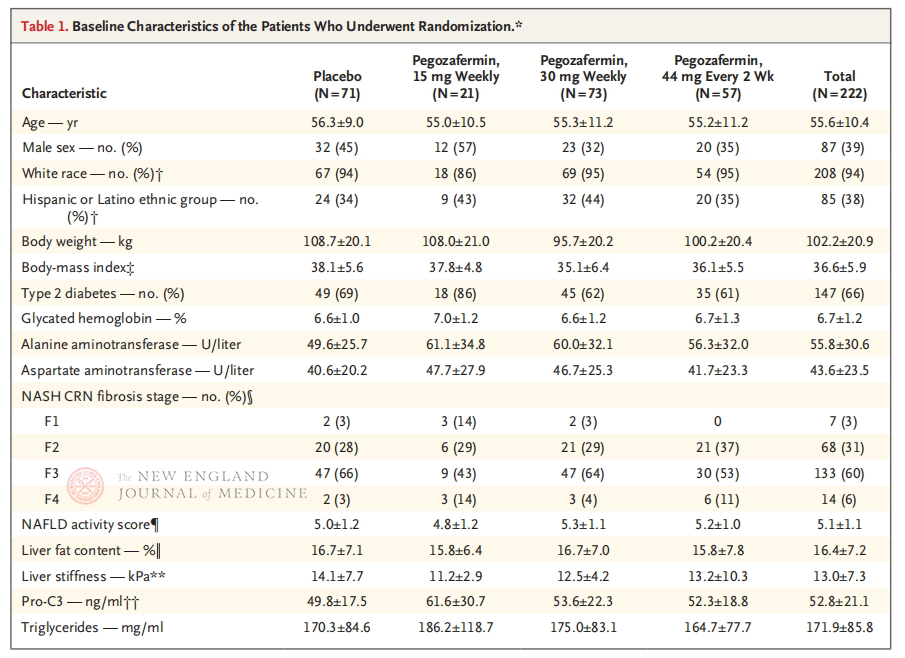
ການທົດລອງທາງດ້ານຄລີນິກ multicenter, randomized, double-blind, placebo-controlled Phase 2b, ດໍາເນີນການໂດຍອາຈານ Rohit Loomba ແລະທີມງານທາງດ້ານການຊ່ວຍຂອງລາວຢູ່ມະຫາວິທະຍາໄລຄາລິຟໍເນຍ, ໂຮງຮຽນການແພດ San Diego, ໄດ້ລົງທະບຽນຄົນເຈັບ 222 ຄົນທີ່ມີຂັ້ນຕອນການຢັ້ງຢືນ biopsie F2-3 NASH ໃນລະຫວ່າງເດືອນກັນຍາ 28, 202021. ເພື່ອ pegozafermin (ການສັກຢາ subcutaneous, 15 mg ຫຼື 30 mg ຄັ້ງຕໍ່ອາທິດ, ຫຼື 44 mg ຄັ້ງທຸກໆ 2 ອາທິດ) ຫຼື placebo (ຫນຶ່ງຄັ້ງຕໍ່ອາທິດຫຼືຫນຶ່ງຄັ້ງໃນທຸກໆ 2 ອາທິດ). ຈຸດສິ້ນສຸດເບື້ອງຕົ້ນລວມມີການປັບປຸງ ≥ ຂັ້ນຕອນທີ 1 ໃນ fibrosis ແລະບໍ່ມີການກ້າວຫນ້າຂອງ NASH. NASH ແກ້ໄຂໂດຍບໍ່ມີການກ້າວຫນ້າຂອງ fibrotic. ການສຶກສາຍັງໄດ້ດໍາເນີນການປະເມີນຄວາມປອດໄພ.
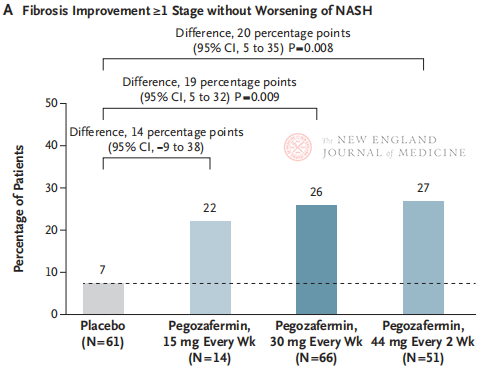
ຫຼັງຈາກການປິ່ນປົວ 24 ອາທິດ, ອັດຕາສ່ວນຂອງຄົນເຈັບທີ່ມີ ≥ ໄລຍະ 1 ການປັບປຸງຂອງ fibrosis ແລະບໍ່ມີອາການຮ້າຍແຮງຂຶ້ນຂອງ NASH, ແລະອັດຕາສ່ວນຂອງຄົນເຈັບທີ່ມີ regression ຂອງ NASH ແລະບໍ່ຮ້າຍແຮງຂຶ້ນຂອງ fibrosis ແມ່ນສູງຂຶ້ນຢ່າງຫຼວງຫຼາຍໃນສາມກຸ່ມປະລິມານ Pegozafermin ກ່ວາກຸ່ມ placebo, ມີຄວາມແຕກຕ່າງຫຼາຍໃນຄົນເຈັບທີ່ໄດ້ຮັບການປິ່ນປົວດ້ວຍ 44 mg ທຸກໆສອງອາທິດຫຼື 30 mg ຄັ້ງຫນຶ່ງ. ໃນດ້ານຄວາມປອດໄພ, pegozafermin ແມ່ນຄ້າຍຄືກັນກັບ placebo. ເຫດການທາງລົບທົ່ວໄປທີ່ສຸດທີ່ກ່ຽວຂ້ອງກັບການປິ່ນປົວ pegozafermin ແມ່ນອາການປວດຮາກ, ຖອກທ້ອງ, ແລະ erythema ຢູ່ບ່ອນສັກຢາ. ໃນການທົດລອງໄລຍະ 2b ນີ້, ຜົນໄດ້ຮັບເບື້ອງຕົ້ນແນະນໍາວ່າການປິ່ນປົວດ້ວຍ pegozafermin ປັບປຸງ fibrosis ຕັບ.
pegozafermin, ນໍາໃຊ້ໃນການສຶກສານີ້, ເປັນ analogue glycolated ທີ່ມີປະສິດຕິພາບຍາວຂອງປັດໄຈການຂະຫຍາຍຕົວ fibroblast ຂອງມະນຸດ 21 (FGF21). FGF21 ແມ່ນຮໍໂມນ metabolism endogenous ທີ່ secreted ໂດຍຕັບ, ເຊິ່ງມີບົດບາດໃນການຄວບຄຸມ lipid ແລະ glucose metabolism. ການສຶກສາທີ່ຜ່ານມາໄດ້ສະແດງໃຫ້ເຫັນວ່າ FGF21 ມີຜົນກະທົບປິ່ນປົວຕໍ່ຄົນເຈັບ NASH ໂດຍການເພີ່ມຄວາມອ່ອນໄຫວຂອງ insulin ຕັບ, ກະຕຸ້ນການຜຸພັງຂອງອາຊິດໄຂມັນ, ແລະຍັບຍັ້ງ lipogenesis. ຢ່າງໃດກໍ່ຕາມ, ເຄິ່ງຊີວິດສັ້ນຂອງ FGF21 ທໍາມະຊາດ (ປະມານ 2 ຊົ່ວໂມງ) ຈໍາກັດການນໍາໃຊ້ຂອງມັນໃນການປິ່ນປົວທາງດ້ານຄລີນິກຂອງ NASH. pegozafermin ໃຊ້ເທກໂນໂລຍີ pegylation glycosylated ເພື່ອຂະຫຍາຍເຄິ່ງຊີວິດຂອງ FGF21 ທໍາມະຊາດແລະເພີ່ມປະສິດທິພາບກິດຈະກໍາທາງຊີວະພາບຂອງມັນ.
ນອກເຫນືອຈາກຜົນໄດ້ຮັບໃນທາງບວກໃນການທົດລອງທາງດ້ານຄລີນິກໄລຍະ 2b ນີ້, ການສຶກສາໃຫມ່ທີ່ຕີພິມໃນ Nature Medicine (ENTRIGUE) ສະແດງໃຫ້ເຫັນວ່າ pegozafermin ຍັງຫຼຸດລົງຢ່າງຫຼວງຫຼາຍ triglycerides, cholesterol ທີ່ບໍ່ແມ່ນ HDL, apolipoprotein B, ແລະ hepatic steatosis ໃນຄົນເຈັບທີ່ມີ hypertriglyceridemia ຮ້າຍແຮງ, ເຊິ່ງອາດຈະມີຜົນກະທົບທາງບວກຕໍ່ການຫຼຸດຜ່ອນຄວາມສ່ຽງ cardiovascular.
ການສຶກສາເຫຼົ່ານີ້ຊີ້ໃຫ້ເຫັນວ່າ pegozafermin, ເປັນຮໍໂມນ metabolic endogenous, ສາມາດໃຫ້ຜົນປະໂຫຍດການເຜົາຜະຫລານອາຫານຫຼາຍຢ່າງໃຫ້ແກ່ຄົນເຈັບທີ່ມີ NASH, ໂດຍສະເພາະແມ່ນຍ້ອນວ່າ NASH ອາດຈະຖືກປ່ຽນຊື່ເປັນພະຍາດຕັບໄຂມັນທີ່ກ່ຽວຂ້ອງກັບການເຜົາຜະຫລານອາຫານໃນອະນາຄົດ. ຜົນໄດ້ຮັບເຫຼົ່ານີ້ເຮັດໃຫ້ມັນເປັນຢາທີ່ມີທ່າແຮງທີ່ສໍາຄັນສໍາລັບການປິ່ນປົວ NASH. ໃນເວລາດຽວກັນ, ຜົນໄດ້ຮັບການສຶກສາໃນທາງບວກເຫຼົ່ານີ້ຈະສະຫນັບສະຫນູນ pegozafermin ເຂົ້າໄປໃນໄລຍະ 3 ການທົດລອງທາງດ້ານການຊ່ວຍ.
ເຖິງແມ່ນວ່າການປິ່ນປົວທັງສອງອາທິດ 44 mg ຫຼືອາທິດ 30 mg pegozafermin ໄດ້ບັນລຸຈຸດສຸດທ້າຍຂອງການທົດລອງ histological, ໄລຍະເວລາຂອງການປິ່ນປົວໃນການສຶກສານີ້ແມ່ນພຽງແຕ່ 24 ອາທິດ, ແລະອັດຕາການປະຕິບັດຕາມໃນກຸ່ມ placebo ແມ່ນພຽງແຕ່ 7%, ເຊິ່ງຕໍ່າກວ່າຜົນຂອງການສຶກສາທາງດ້ານການຊ່ວຍທີ່ຜ່ານມາ 48 ອາທິດ. ຄວາມແຕກຕ່າງແລະຄວາມປອດໄພແມ່ນຄືກັນບໍ? ເນື່ອງຈາກຄວາມແຕກຕ່າງກັນຂອງ NASH, ຂະຫນາດໃຫຍ່, ຫຼາຍສູນກາງ, ການທົດລອງທາງດ້ານຄລີນິກສາກົນແມ່ນຈໍາເປັນໃນອະນາຄົດເພື່ອປະກອບມີປະຊາກອນຄົນເຈັບທີ່ໃຫຍ່ກວ່າແລະຂະຫຍາຍໄລຍະເວລາການປິ່ນປົວເພື່ອປະເມີນປະສິດທິພາບແລະຄວາມປອດໄພຂອງຢາ.
ເວລາປະກາດ: ກັນຍາ-16-2023